Aus unserer Welt sind
Obwohl es allgemein und schon lange bekannt ist, dass die derzeitigen Antibiotika nur begrenzt wirksam sind, und trotz klarer Warnungen aus Forschung, Medizin und durch Organisationen wie der WHO gab es in den letzten Jahrzehnten wenig Initiative, neue Antibiotika zu finden oder Alternativen zu erforschen. Für die großen Pharmakonzerne lohnt sich die Suche nach neuen Wirkstoffklassen nicht. Ihre Entwicklung ist sowohl langwierig als auch teuer und weil nicht zu erwarten ist, dass sie mit den kostengünstigen Antibiotika konkurrieren können, ist wenig Rendite zu erwarten.
Bakterienfresser – das Heilmittel gegen Antibiotikaresistenz?
Als vielversprechende Kandidaten im Kampf gegen multiresistente Keime gelten Bakteriophagen. Phagen sind Viren, die ganz gezielt Bakterien angreifen und zerstören können. Sie sind also ihre natürlichen Feinde, die sich seit fast 4 Milliarden Jahren gemeinsam mit Bakterien entwickelt haben. Bakteriophagenpartikel finden sich überall in der Biosphäre, genau genommen gelten sie als die am häufigsten vorkommenden biologischen Einheiten auf dem Planeten. In Tieren und Menschen bilden sie einen Teil der natürlichen Mikroflora. Ihrem Aussehen nach könnte man sie für kleine Mondlandefähren halten. Sie docken aber nicht an jedes beliebige Bakterium an, sondern jeder Phage ist hochspezifisch an ein bestimmtes Wirtsbakterium angepasst. Er „landet“ also nur auf einem ganz bestimmten Stamm, injiziert dann sein Erbgut und missbraucht die Wirtsmaschinerie, um sich zu replizieren. Ist das Bakterium am Ende dieses Zyklus voll mit neuen Phagen, platzt es und die Viren werden freigesetzt.
Entdeckt wurden die „Bakterienfresser“ bereits vor über 100 Jahren vom französischen Mikrobiologen Felix d’Herelle. Er hatte 1919 erfolgreich Phagenpräparate zur Behandlung von Kindern eingesetzt, die an bakterieller Ruhr litten – eine ansteckende Durchfallerkrankung, die durch eine Infektion mit Bakterien entsteht – woraufhin die Phagentherapie in den 1930er Jahren umfassend zur Behandlung bakterieller Infektionen bei Menschen und Tieren eingesetzt wurde, lange bevor das Antibiotikum Penicillin auf den Markt kam. Das erste Phagentherapiezentrum wurde im heutigen Tiflis in Georgien eröffnet, gefolgt von einem weiteren im polnischen Breslau; beide Zentren bestehen bis heute. Nachdem jedoch in den frühen 1940er Jahren Penicillin auf den Markt kam, geriet die Phagentherapie im Westen weitestgehend in Vergessenheit. In einigen Ländern der ehemaligen Sowjetunion und Polen werden Phagen dagegen bis heute in der Humanmedizin eingesetzt.
Angesichts der weltweit wachsenden Bedrohung durch Antibiotikaresistenzen für die Gesundheit von Mensch, Tier und Umwelt geraten Phagen nun auch im Westen wieder in den Fokus. Ihr Potential wird sowohl in der Medizin als auch innerhalb der Land- und Lebensmittelwirtschaft gesehen.
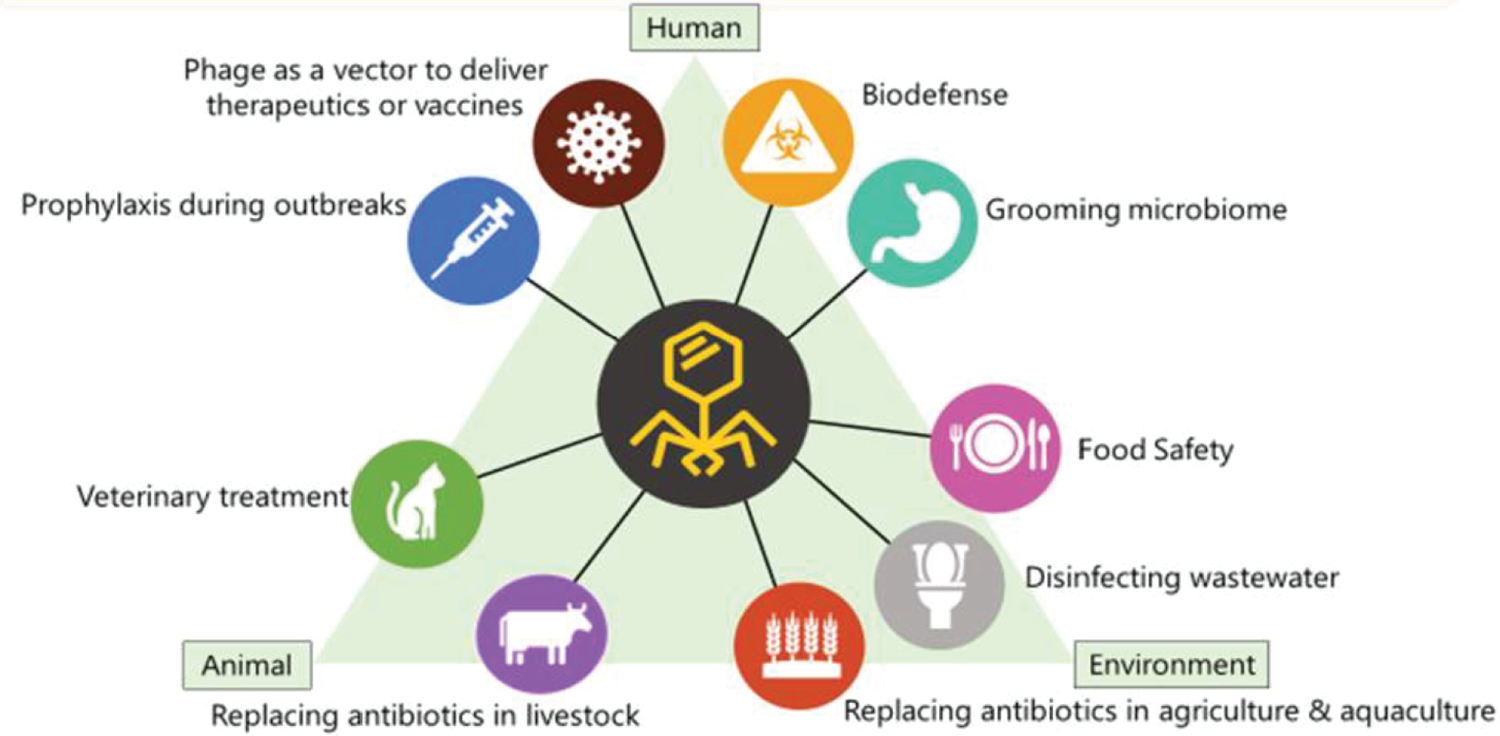
Erfahrungen aus dem knapp 100-jährigen Einsatz haben bereits gezeigt, dass sie eine sichere Therapieoption mit wenigen Nebenwirkungen darstellen könnten. Eine genauere Betrachtung macht sogar deutlich, dass Phagen einige Vorteile im Vergleich zu klassischen Antibiotika bieten. Wie der Name schon sagt, wirken Antibiotika nicht spezifisch. Angegriffen werden nicht nur die für die Infektion verantwortlichen Bakterien, sondern auch unser gesundes
Da jede Phagenart nur ganz bestimmte Bakterien infiziert, bleiben schädliche Nebenwirkungen auf die „guten“ Bakterien in unserem Mikrobiom aus. Manche Phagen könnten darüber hinaus zur Bekämpfung von Bakterien in sogenannten Biofilmen verwendet werden. In Biofilmen sind Bakterien in eine von ihnen selbst produzierte schleimartige Matrix eingebettet, die sie vor Antibiotika oder Desinfektionsmitteln schützen kann. Somit spielen sie oft eine wichtige Rolle bei schwer behandelbaren Infektionen in der Medizin, vor allem von Implantaten, sowie in der lebensmittelverarbeitenden Industrie.
Trotz dieses Potenzials sind Phagenpräparate innerhalb der EU und Deutschland aktuell noch nicht zugelassen. Ohne Marktzulassung als Arzneimittel können Phagen nur in besonderen Einzelfällen für personalisierte bzw. experimentelle Behandlungen chronischer und antibiotikaresistenter Infektionen genutzt werden, wenn keine wirksamen Medikamente mehr verfügbar sind. Solch individuelle Heilversuche wurden seit der „Neuentdeckung“ von Phagen inzwischen weltweit in verschiedenen Zentren erfolgreich durchgeführt und dokumentiert – auch in Deutschland, wie der Artikel von Bröcker und seinen Kolleg:innen zusammenfasst.
Wenn der gesetzliche Rahmen zur Bremse wird
Die verwendeten Phagenpräparate kamen entweder aus dem Ausland oder sie wurden im Rahmen einer erlaubnisfreien Produktion im jeweiligen Krankenhaus für die eigenen Patienten unter Aufsicht des behandelnden Arztes produziert. Auch wenn diese Behandlungen erfolgreich waren und Leben retten konnten, waren es lediglich Fallstudien. Um die Zulassung von „off-the-shelf“ Phagenpräparaten oder eine etablierte Infrastruktur für personalisierte Therapien zu ermöglichen, besteht noch Handlungsbedarf. Denn die Kosten für Forschung, klinische Studien und den Aufbau von Produktionsstätten sind hoch und auch der Prozess, passende Phagen für die jeweilige Bakterieninfektion zu finden und zu charakterisieren, ist komplex. Doch vor allem hängt eine breite Verwendung von Phagenpräparaten davon ab, dass die EU einen gesetzlichen Rahmen dafür schafft. Zu diesem Schluss kommt auch ein Bericht des Büros für Technikfolgen-Abschätzung beim Deutschen Bundestag (TAB), der im vorigen Jahr vorgelegt wurde und Potenzial und Problematik des Einsatzes von Phagen beleuchtet und ergänzende Einblicke in die EU-spezifischen Rahmenbedingungen liefert.
Im Gegensatz zu Antibiotika sind Bakteriophagen kein klar definierter Wirkstoff. Bakterielle Infektionen werden oft durch mehrere Erreger bzw. Erregerstämme in einer von Patient zu Patient variablen Zusammensetzung verursacht. Deshalb, und um bakteriellen Phagenresistenzen vorzubeugen, reicht es nicht einfach, einen bestimmten Bakteriophagen zu verabreichen. Es müssen wirksame Phagenpräparate als abgestimmter Cocktail aus mehreren spezifischen Phagen kombiniert und mitunter im Verlauf der Behandlung individuell angepasst werden. Einen derart flexibel anpassbaren Herstellungsprozess lässt der derzeitige gesetzliche Rahmen schlicht nicht zu, der weitgehend auf unveränderliche Wirkstoffkombinationen und Standardtherapien ausgerichtet ist. Würde man beispielsweise alleine einen Phagen aus dem Cocktail austauschen, um optimal auf die Infektion zu reagieren, würde das bereits ein erneutes Zulassungsverfahren nach sich ziehen. Alle Phagen einzeln zuzulassen, wäre aufgrund Ihrer Diversität schlicht unmöglich.
Damit die klinische Anwendung von Phagenprodukten im Kampf gegen multiresistente Keime einen entscheidenden Schritt nach vorne machen kann, müssten also die rechtlichen Voraussetzungen an die gegebenen Anforderungen angepasst werden. Es fehlen zudem bisher spezifische Qualitätskriterien sowie zuverlässige Daten zur Sicherheit und Wirksamkeit der Phagentherapie. Entsprechende klinische Studien laufen nun zunehmend an. Strathdee und Kollegen sind sich indes einig, dass es in diesem Zusammenhang enorm wichtig wäre, durch gezielte Vernetzung einen globalen Austausch zu fördern, um so koordinierte Ansätze in Bezug auf standardisierte Richtlinien und Studienprotokolle anzustreben. Um die Verfügbarkeit und Herstellung von Phagen in klinischer Qualität und ausreichender Menge sicherzustellen und die hohen Kosten zu senken, wäre es ideal, sogenannte „Phagenbibliotheken“, also Sammlungen von Phagen, auf die zurückgegriffen werden kann, und Good Manufacturing Practice (GMP) Einrichtungen als gemeinsame Ressourcen zu entwickeln. Gezielte Förderprogramme können diesen Prozess weiter unterstützen. Das von der Bundesagentur für Sprunginnovationen SPRIN-D initiierte Phage2030 hat beispielsweise die Erarbeitung eines Konzepts mit den notwendigen Schritten zur Etablierung eines Zentrums für Bakteriophagenforschung, -anwendung und -herstellung in Deutschland im Fokus.
Der Einsatz von Phagen birgt also durchaus vielversprechende Chancen als ergänzende Therapie zur klassischen Antibiotikabehandlung. Es lässt sich hoffen, dass koordinierte Bemühungen und ein intensiver Austausch zwischen Wissenschaft, Politik, Wirtschaft und Regulierungsbehörden die Entwicklung von wirksamen und sicheren Präparaten in die nähere Zukunft rücken lassen. Ihr Einsatz in der Humanmedizin, aber auch in Landwirtschaft und Lebensmittelindustrie könnte ein Baustein sein, den bedrohlichen Anstieg nicht mehr in den Griff zu bekommender Infektionen einzudämmen.

